Für Ärzte und Therapeuten
Das Laktobazillen-Schutzsystem
Das Laktobazillen-Schutzsystem
- und ein kraftloser Lactobacillus iners
Sobald die Pubertät beginnt, gehen Frauen mit den Milchsäurebakterien am Vaginalepithel eine Symbiose ein. Mit der Östrogenisierung entsteht dort ein attraktiver Lebensraum: In den Epithelzellen reichert sich ständig neues Glykogen an, von dem sich die Laktobazillen ernähren. Dabei bilden sie Milchsäure, die den Laktobazillen selbst und den besiedelten Frauen entscheidende Vorteile verschafft: Die Milchsäure wirkt effektiv gegen unerwünschte Erreger. Dank der Milchsäure und weiterer Abwehrmechanismen können die Laktobazillen das Vaginalsekret bei gesunden Frauen mit einer Zellzahl von bis zu 10¹⁰ Laktobazillen pro Milliliter dominieren.
Bereits 1892 hat der Gynäkologe Albert Döderlein erstmals die Milchsäurebakterien im Vaginalsekret beschrieben, sie sind deshalb auch unter dem Namen Döderlein-Bakterien bekannt.
Häufige Laktobazillen-Arten in der Vagina
Die vaginale Mikrobiota besteht aus bis zu 600 verschiedenen bakteriellen Arten (1), allerdings dominieren meist eine oder zwei Laktobazillen-Arten. Lange galten Bakterien der Lactobacillus-acidophilus-Gruppe als die vorherrschenden Laktobazillen in der Vagina. Inzwischen ist aber bekannt:
- Lactobacillus gasseri
- Lactobacillus crispatus
- Lactobacillus jensenii
- Lactobacillus iners
kommen am häufigsten vor (2,3).
Hohe Zellzahlen von Lactobacillus crispatus, Lactobacillus gasseri oder Lactobacillus jensenii stehen für eine schützende vaginale Mikrobiota (4), während eine Lactobacillus-iners-dominierte Mikrobiota als instabil gilt und Wegbereiter für eine bakterielle Vaginose sein kann. Um sich als dominierende Bakterien im Vaginalbereich behaupten zu können, müssen die schützenden Laktobazillen eine Zellzahl von mindestens 10⁸ pro Milliliter Vaginalsekret erreichen (3).


So schützen Laktobazillen
Um ihren Lebensraum gegen andere Mikroorganismen zu verteidigen, haben einige Laktobazillen-Arten besondere Fähigkeiten ausgebildet. Damit schützen die Laktobazillen-Arten den Vaginalbereich insgesamt vor unerwünschten Erregern:
- Sie bilden einen dichten Bakterienrasen am vaginalen Epithel und behindern die Besiedlung mit schädlichen Erregern.
- Sie produzieren Abwehrstoffe wie Milchsäure, H2O2, Bakteriozine, Bindungsmoleküle und oberflächenaktive Substanzen.
- Sie regen die vaginale Immunabwehr an, ohne dabei eine Entzündung auszulösen (5).
- Sie wirken entzündungshemmend und schützen so das Epithel (4,5,6).
Eine Ausnahme unter den Laktobazillen bildet Lactobacillus iners: Das Bakterium verfügt nur über wenige Schutzmechanismen und wirkt sogar entzündungsfördernd.
Kolonisationsresistenz: Kein Platz für Krankheitserreger
Die Laktobazillen einer gesunden Vaginalflora heften sich über Adhäsine (3) an das vaginale Epithel und bilden dort Mikrokolonien (7,8). Bedecken die Laktobazillen das Epithel lückenlos, können Infektionserreger nicht mehr zum Epithel vordringen, um sich anzusiedeln. Das wurde für Gardnerella vaginalis, pathogene E. coli (4,8) und den Parasiten Trichomonas vaginalis nachgewiesen – und gilt wahrscheinlich auch für das Herpes-simplex-Virus 2 (4).

Milchsäure - mehr als nur sauer
Die von den Laktobazillen gebildete Milchsäure5 senkt den pH-Wert in der gesunden Vagina auf unter 4,5 und hemmt das Wachstum unerwünschter Erreger. Entsprechend galt ein saurer pH-Wert lange Zeit als verlässlicher Indikator für ein gesundes Vaginalmilieu. Inzwischen haben Forschungen jedoch gezeigt: Entscheidend ist nicht der Säuregrad (6,9), sondern die Art der Säure, die den pH-Wert senkt. Drückt Milchsäure den pH-Wert auf 4,5, hemmt das Erreger wie Gardnerella vaginalis und Atopobium vaginae (9). Ist dagegen Essigsäure für einen pH-Wert von 4,5 verantwortlich, können die Erreger ungehindert wachsen (9).
Bei einer bakteriellen Vaginose kann also durchaus ein saurer pH-Wert vorliegen. Er geht dann oft auf Succinat und Essigsäure zurück – Säuren, die von unerwünschten Begleitbakterien und pathogenen Erregern selbst gebildet und entsprechend toleriert werden.
Milchsäure wirkt auf eine ganze Reihe von Erregern mikrobiozid oder viruzid. Dazu zählen:
- Gardnerella vaginalis
- Atopobium vaginae
- apathogene E. coli
- Neisseria gonorrhoeae
- Chlamydia trachomatis
- das HI-Virus und
- das Herpes-simplex-Virus.
Über den pH-Wert alleine lässt sich nicht ermitteln, wie effektiv das vaginale Milieu vor Krankheitserregern schützt.
Außerdem unterstützt die Milchsäure Reparaturmechanismen in vaginalen Epithelzellen und regt das Immunsystem an, Stoffe gegen pathogene Bakterien wie Gardnerella vaginalis zu produzieren (5). Sie kann auch die Bildung eines Enzyms vermindern, das den zervikalen Schleimpfropf abbaut. Der Schleimpfropf hält Bakterien davon ab, in den oberen Genitaltrakt einzuwandern (5). Damit kann die Milchsäure vor Infektionen des oberen Genitaltraktes schützen – und Schwangere vor Schwangerschaftskomplikationen.
Entgiften als Waffe: Wasserstoffperoxid
Laktobazillen sind als fakultative Anaerobier nicht auf Sauerstoff angewiesen, im Gegenteil: Sauerstoff reagiert leicht mit anderen Stoffen und kann damit großen Schaden anrichten. Deshalb entgiften ihn einige Laktobazillen-Arten über Enzyme wie die Peroxidase (3,10) Dabei entsteht ein effektiver Abwehrstoff – das Wasserstoffperoxid (H2O2). Zu den Wasserstoffperoxid-bildenden Bakterien zählen Lactobacillus gasseri, Lactobacillus crispatus, Lactobacillus jensenii und Lactobacillus acidophilus.(3,11)
Wasserstoffperoxid lässt die DNA vieler pathogener Bakterien brechen. Das saure Milieu der gesunden Vagina verstärkt die mikrobiozide Wirkung des Wasserstoffperoxids noch.(12) Für die Vaginalgesundheit ist eine ausreichende Besiedlung mit H2O2-bildenden Laktobazillen entscheidend: Es kommt seltener zu Vaginosen (2,13), Frühgeburten und HIV-Infektionen. Die Schwangerschaftsraten nach einer in vitro-Fertilisation liegen deutlich höher.(6)
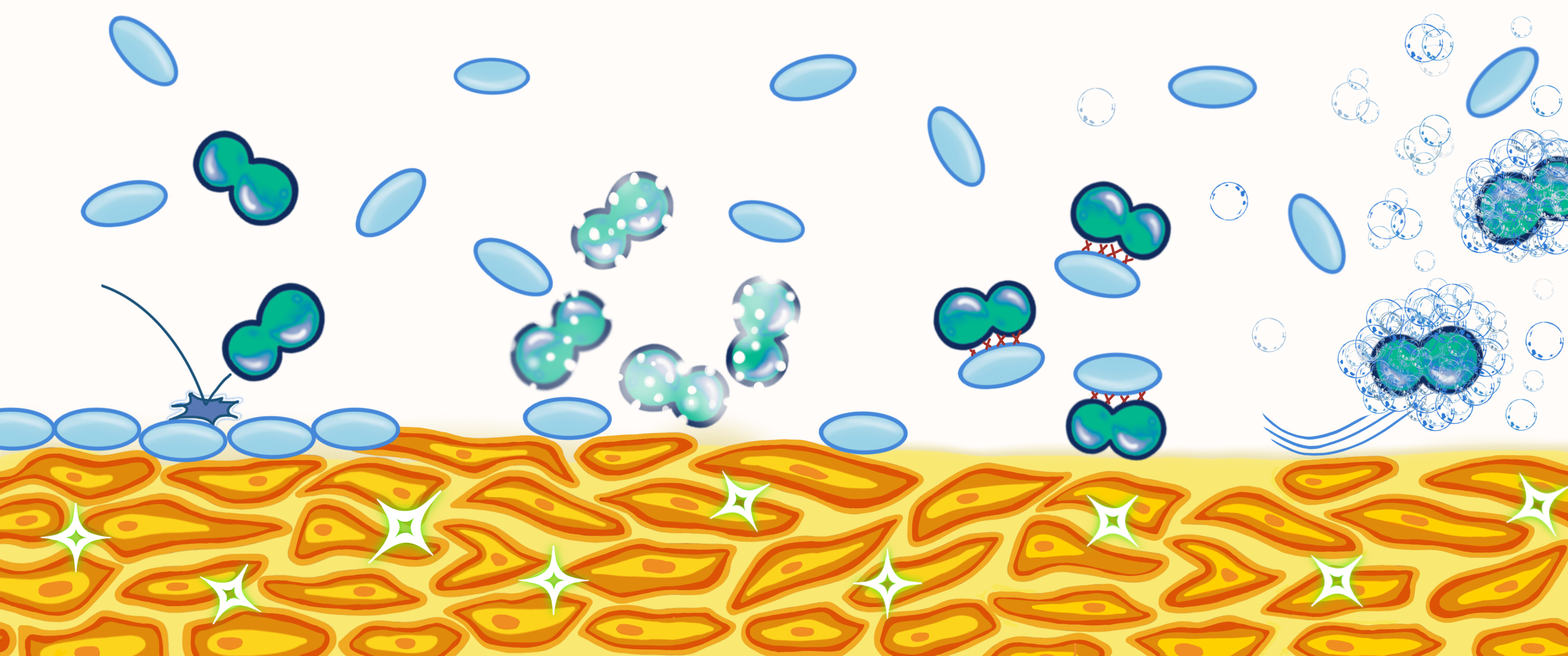
Attackieren, Binden, Schmieren
Die Laktobazillen verfügen noch über weitere Abwehrmechanismen, um sich in der Vagina zu behaupten:
- Sie attackieren zum Beispiel Infektionserreger mit Bakteriozinen und hemmen so deren Wachstum (4,10). Bakteriozine sind antimikrobielle Peptide, die die ribosomale RNA der Erreger spalten, ihre DNA-Synthese hemmen oder Poren in der Bakterienmembran bilden können.
- Laktobazillen können pathogene Bakterien auch binden. Dadurch können die pathogenen Bakterien das vaginale Epithel nicht mehr kolonisieren (14). Wieder verbessert ein saurer pH-Wert die Bindung und damit den Schutz vor pathogener Besiedlung (15).
- Außerdem können die Laktobazillen oberflächenaktive Substanzen (14) ausscheiden, mit denen sie die pathogenen Erreger regelrecht schmieren. Oberflächenaktive Substanzen kommen zum Beispiel als aktive Agenzien in Waschmitteln vor. Dadurch gelingt es den pathogenen Erregern nicht mehr, sich an das Vaginalepithel anzuheften.
Lactobacillus iners: Marker für hohes Rezidivrisiko
Lactobacillus iners schützt nicht wie andere Milchsäurebakterien: Er bildet weder Wasserstoffperoxid noch Bakteriozine oder Adhäsine. Seine fehlenden Fähigkeiten wurden offensichtlich bei der Namensgebung berücksichtigt. Das lateinische iners steht für ohne Können oder Geschick, kraftlos und wirkungslos. Entsprechend sind hohe Zellzahlen von Lactobacillus iners mit einer instabilen Mikrobiota assoziiert – bis hin zur bakteriellen Vaginose (2). Einer Studie zufolge war auch das Risiko für eine Chlamydien-Infektion bei Frauen mit Lactobacillus-iners-dominierter Vaginalflora um das 2,6-Fache erhöht (16).
Lactobacillus iners schützt nicht nur weniger, er kann auch direkt Schaden anrichten: Er scheidet die gleichen Zytotoxine aus wie Gardnerella vaginalis (17) und regt das vaginale Epithel an, pro-inflammatorische Zytokine freizusetzen (18).
Die Menstruation ist eine besonders sensible Phase für eine Besiedlung mit Lactobacillus iners: Das Bakterium kann in dieser Zeit zu hohen Zellzahlen heranwachsen, zusammen mit Gardnerella vaginalis und Atopobium vaginae (4,12). Die Zellzahlen von H2O2-bildenden Laktobazillen können dagegen während der Menstruation auf ein Hundertstel zurückgehen.
Möglicherweise kann sich Lactobacillus iners sogar auf das Verhalten von Neugeborenen auswirken, wenn er während der Geburt von der Mutter auf den Säugling übergeht. Im Darm übermäßig schreiender Säuglinge fanden Wissenschaftler mehr als doppelt so viele Lactobacillus-iners-Bakterien als im Darm ruhigerer Babys (19).
Literatur
- Diop, K. et al., 2019: Exhaustive repertoire of human vaginal microbiota. Human Microbiome Journal 11: 1000512. doi.org/10.1016/j.humic.2018.11.002.
- Mendling, W. Vaginal Microbiota. In: Microbiota of the human body, A. Schwiertz (Hrsg.), Springer Verlag 2016.
- Schwiertz, A., 2010: Alles eine Frage des Gleichgewichts. Gynäkologie und Geburtshilfe 7-8: 1.
- Petrova, M. I. et al., 2015: Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Frontiers in Physiology 6: Artikel 81.
- Witkin, S. S. and I. M. Linhares, 2016: Why do physiological lactobacilli dominate the human vaginal microbiota? BJOG 124: 606.
- Mitchell, C. et al., 2015: Hydrogen-peroxide producing lactobacilli are associated with lower levels of vaginal IL1, independent of bacterial vaginosis. Sex Transm Dis. 42: 358.
- Stapelton, A. E., 2016: The Vaginal Microbiota and Urinary Tract Infection. Microbiol Spectr. 4(6): 10.1128/microbiolspec.UTI-0025-2016. doi: 10.1128/microbiolspec.UTI-0025-2016.
- Petrova, M. I. et al., 2013: Vaginal microbiota and its role in HI Vtransmission and infection. FEMS Microbiol Rev. 37: 762.
- O'Hanlon, D. E. et al., 2011: In vaginal fluid, bacteria associated with bacterial vaginosis can be suppressed with lactic acid but not hydrogen peroxide. BMC Infectious Diseases 11: 200. doi: 10.1186/1471-2334-11-200.
- Mokoena, M. P., 2017: Lactic Acid Bacteria and Their Bacteriocins: Classification, Biosynthesis and Applications against Uropathogens: A Mini-Review. Molecules 22: 1255.
- Vitali, B. et al., 2017: Management of Disease and Disorders by Prebiotics and Probiotic Therapy: Probiotics in Bacterial Vaginosis. In: The Microbiota in Gastro-intestinal Pathophysiology, Academic Press.
- Amabebe, E. and D. O. C. Anumba, 2018: The Vaginal Microenvironment: The Physiologic Role of Lactobacilli. Frontiers in Medicine 5: Artikel 181.
- Jespers, V. et al., 2012: Quantification of bacterial species of the vaginal microbiome in different groups of woman, using nucleic acid amplification test. BMC Microbiology 30: 12.
- Reid, G., 2001: Probiotic agents to protect the urogenital tract against infection. AM. J. Clin. Nutr. 73: 437S. doi: 10.1093/ajcn/73.2.437s.
- Ekmekci, H., 2009: Characterization of vaginal lactobacilli coaggregation ability with Escherichia coli. Microbiol Immunol. 53: 59.
- Van Houdt, R. et al., 2018: Lactobacillus iners-dominated vaginal microbiota is associated with increased susceptibility to Chlamydia trachomatis infection in Dutch women: a case-control study. Sex Transm Infect. 94: 117.
- Ragaliauskas, T. et al., 2019: Inerolysin and vaginolysin, the cytolysins implicated in vaginal dysbiosis, differently impair molecular integrity of phospholipid membranes. Sci Rep. 9(1): 10606. doi: 10.1038/s41598-019-47043-5.
- Mendling, M. et al., 2019: An update on the role of Atopobium vaginae in bacterial vaginosis: what to consider when choosing a treatment? A mini review. Arch. Gynecol. Obstr. 300: 1.
- Rhoads, J. M. et al., 2018: Infant Colic Represents Gut Inflammation and Dysbiosis. The Journal of Pediatrics 203: 55.
