Für Ärzte und Therapeuten
Mikrobiota und Metabolisches Syndrom
Darmbakterien greifen in Stoffwechsel ein
Die intestinale Mikrobiota greift über ihre Metaboliten in den menschlichen Stoffwechsel ein und spielt damit eine wichtige Rolle bei der Entstehung des Metabolischen Syndroms. Dabei sind bestimmte Schlüsselarten ("Keystone species") entscheidend, deren Fehlen oder Vorhandensein zu metabolischen Dysbalancen führen.
So dienen die bakteriell produzierten kurzkettigen Fettsäuren Buttersäure, Propionsäure und Essigsäure als Signalmoleküle für den menschlichen Stoffwechsel:
Essigsäure steigert das Hungergefühl und regt die Gluconeogenese und die Liponeogenese an.
Dagegen verstärkt die Propionsäure das Sättigungsgefühl, senkt den Cholesterinspiegel und verbessert die Insulinsensitivität.
Besonders positiv ist ein hoher Anteil an Buttersäure. Sie ernährt die Zellen des Darmepithels und unterstützt so die Barrierewirkung der Darmschleimhaut. Dabei wirkt sie anti-inflammatorisch und anti-kanzerogen.
Die KyberMetabolic-Diagnostik weist die kurzkettigen Fettsäuren nach - zusammen mit bakteriellen Lieferanten der kurzkettigen Fettsäuren, der LPS-tragenden Mikrobiota und dem Durchlässigkeitsmarker Zonulin.
Kurzkettige Fettsäuren aus Ballaststoffen
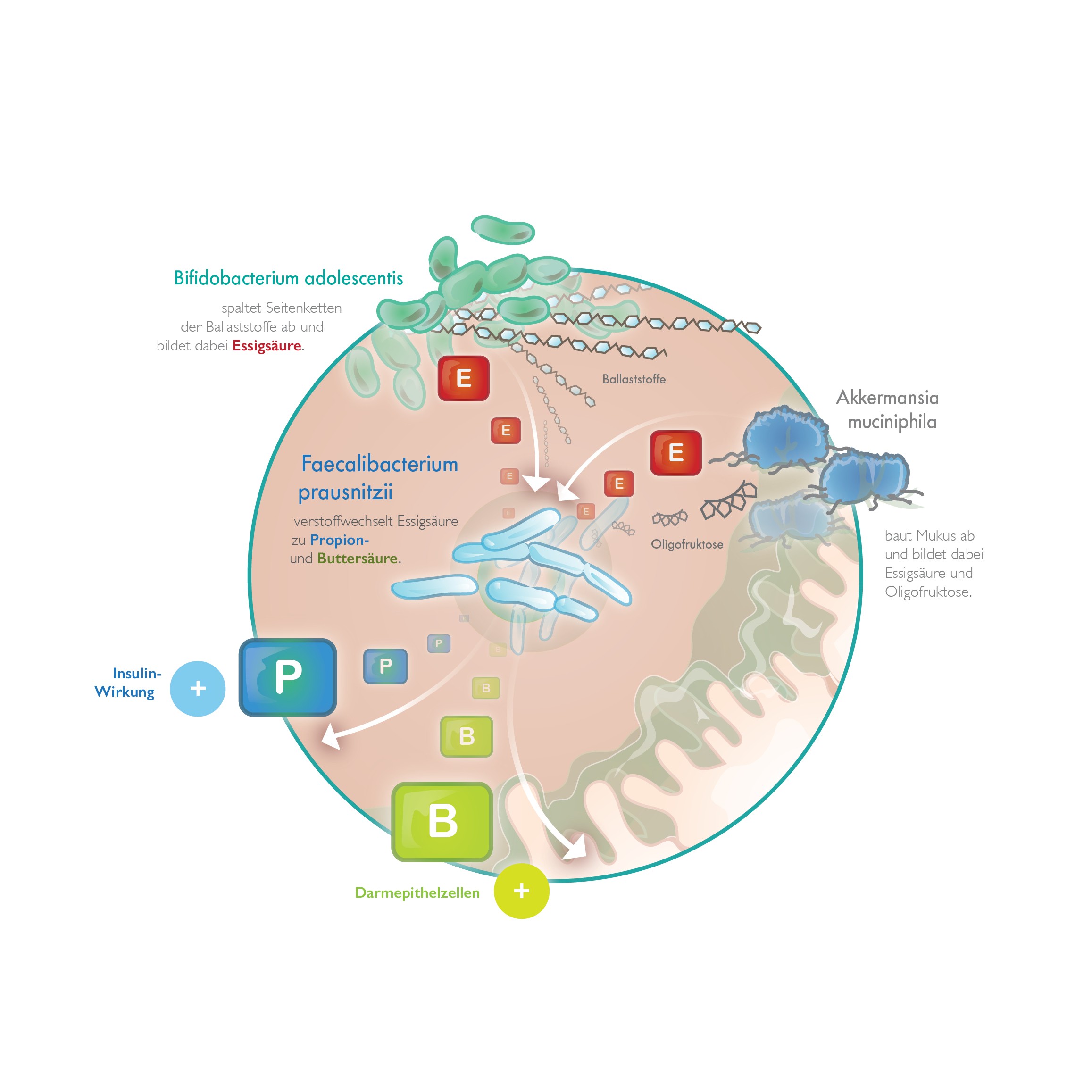
Ausgangsbasis für die kurzkettigen Fettsäuren sind wasserlösliche Ballaststoffe wie resistente Stärke, Inulin und Oligofructose. Der menschliche Körper kann sie nicht abbauen, deshalb gelangen sie unverändert in den Dickdarm. Dort verstoffwechseln die Bakterien die Ballaststoffe. Dabei nimmt Bifidobacterium adolescentis eine Schlüsselstellung ein: Das Bakterium spaltet die kurzen Seitenketten der Polysaccharide ab und bildet daraus Essigsäure. Die Essigsäure dient als Stoffwechselbeschleuniger für Faecalibacterium praunitzii.
Faecalibacterium prausnitzii ist ein wichtiger Buttersäurebildner. Das Bakterium macht bei gesunden Menschen bis zu fünf Prozent der Darmbakterien aus. Es kann Ballaststoffe direkt zu Buttersäure abbauen. Auch verarbeitet Faecalibacterium die Essigsäure, die anfällt, wenn Akkermansia muciniphila den Mukus der Darmschleimhaut abbaut. Der Mukus-Abbau veranlasst die Becherzellen, den Schleim ständig zu erneuern.
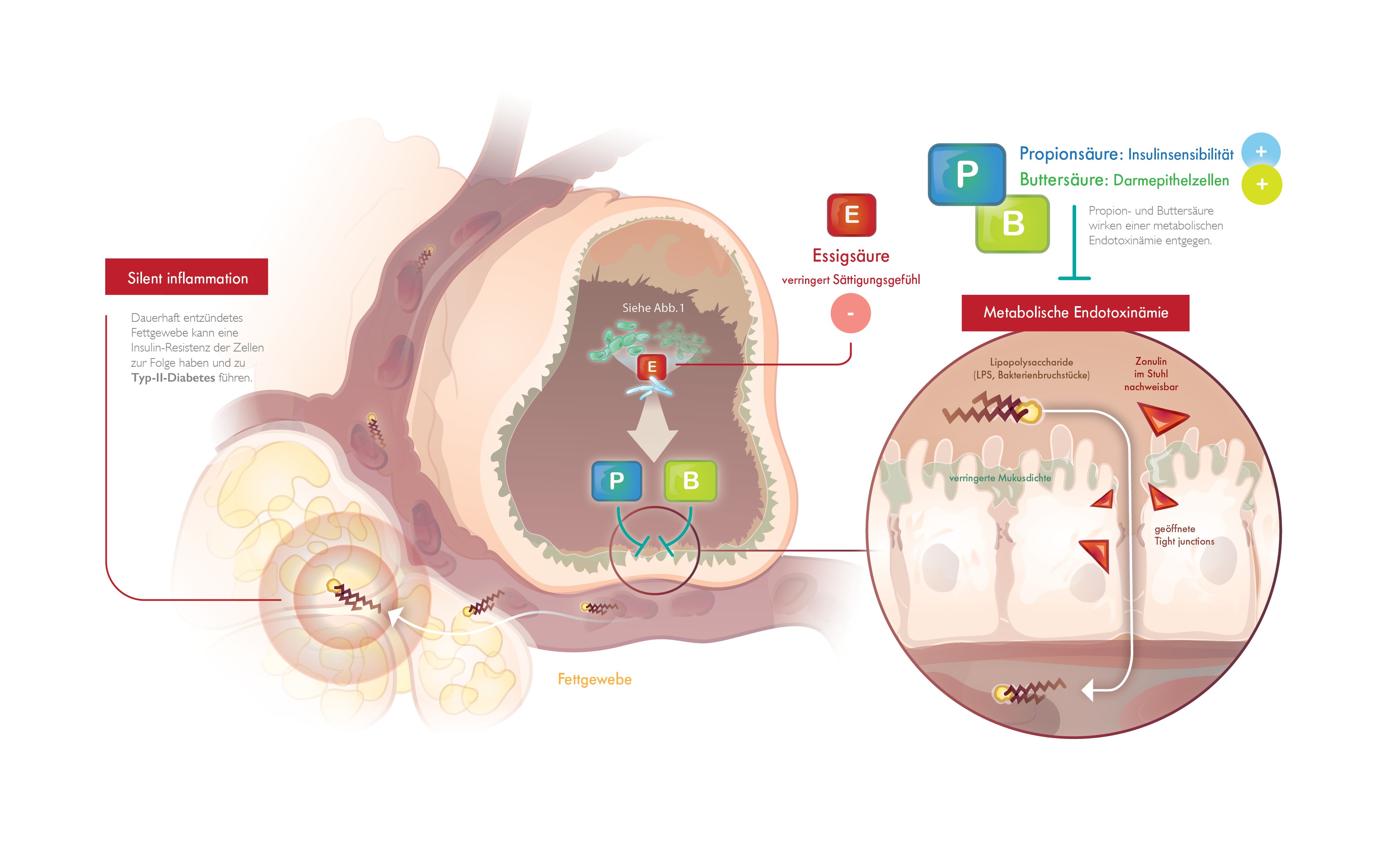

Endotoxinämie als Ursache für Insulinresistenz
Störungen der saccharolytischen und mukonutritiven Mikrobiota bereiten den Weg für das Metabolische Syndrom: Sind die Spiegel von Buttersäure und Propionsäure erniedrigt und der schützende Schleim ausgedünnt, kann ein Leaky gut-Syndrom entstehen. Um das Ausmaß der Permeabilität zu bestimmen, eignet sich das Regulatorprotein Zonulin als Marker.
Ist die Darmschleimhaut übermäßig durchlässig, können bakterielle Endotoxine aus dem Darmlumen in die Lamina propria und den Blutkreislauf übertreten. Für eine subklinisch erhöhte Endotoxin-Konzentration verwendeten Wissenschaftler erstmals 2007 den Begriff der Endotoxinämie. Eine hohe Konzentration gram-negativer Bakterien fördert die Endotoxinämie. Die Bakterien tragen auf der äußeren Zellmembran Lipopolysaccharide (LPS), deren Bestandteile als Endotoxin wirken.
Gelangen die Endotoxine in die Lamina propria und die Leber, werden pro-inflammatorische Zytokine freigesetzt. Das löst eine subklinische Entzündung oder Silent Inflammation aus, die wiederum die Insulinresistenz vorantreibt. Die Insulinresistenz ist maßgeblich an der Pathogenese des Diabetes mellitus Typ 2 beteiligt.
