Für Ärzte und Therapeuten
CardioHeparMetabolic
Das Risiko für Arteriosklerose, Fettleber und Diabetes Typ 2 einschätzen können
CardioHeparMetabolic erkennt Darm-assoziierte Risiken
Die CardioHeparMetabolic-Diagnostik (CHM) erkennt Veränderungen der Darmmikrobiota und ausgewählter Stoffwechselprodukte, die ein Risiko für die Entstehung von Arteriosklerose, nicht-alkoholischer Fettlebererkrankung (NAFLD) und Diabetes Typ 2 darstellen (1,2,3,4).
Die Stuhldiagnostik ist sowohl bei ersten Krankheitszeichen als auch bei bereits manifester Arteriosklerose, Fettleber und Diabetes Typ 2 sinnvoll. Die gezielte Modulation mikrobieller Stoffwechselprodukte ermöglicht eine frühzeitige Intervention und verbessert den Therapieerfolg.




Indikationen für die CHM-Diagnostik
- Übergewicht/Adipositas
- Pathologische Glukosetoleranz (Pre-Diabetes)
- Metabolisches Syndrom
- Vorliegen von Risikofaktoren für Arteriosklerose
- Bluthochdruck
- Diabetes mellitus Typ 2
- Hyperlipidämie (Cholesterin, Triglyceride)
- Hyperhomocysteinämie
- Silent Inflammation
- Erhöhtes Lipoprotein(a)
- Nikotinabusus
- Erhöhte Intima-Media-Dicke in der Duplexsonografie (Erstes Stadium der Gefäßwandveränderung vor Sichtbarkeit von Plaques)
- NAFLD
- Unklare Erhöhung der Leberwerte
- Chronische Lebererkrankungen (im Sinne von Entlastung)
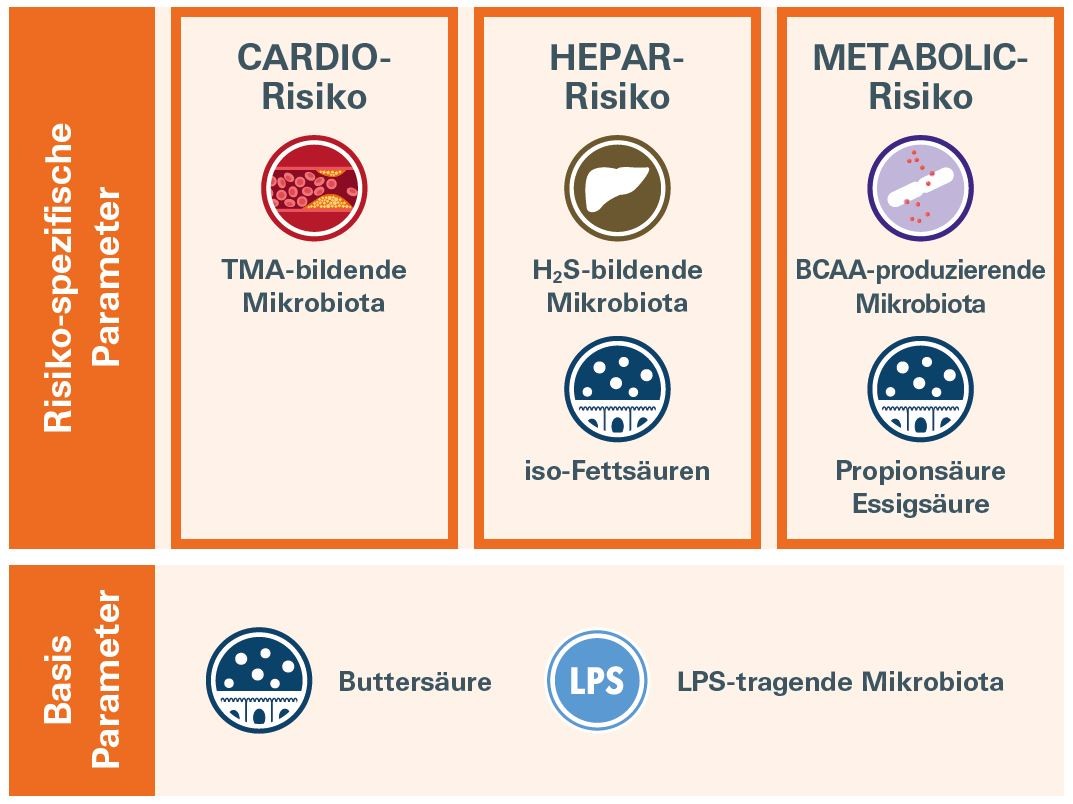
CHM ermittelt drei separate Risiken:
Die Diagnostik ist eine Erweiterung zum KyberBiom®: Neben den CHM-Parametern fließen funktionelle Gruppen aus der KyberBiom®-Diagnostik in die Risikoermittlung ein.
Youtube inaktiv
Aufgrund Ihrer Cookie-Einstellungen kann dieses Modul nicht geladen werden.
Wenn Sie dieses Modul sehen möchten, passen Sie bitte Ihre Cookie-Einstellungen entsprechend an.
Cardio-Risiko – Spezifische Parameter
Die Ermittlung des Darm-assoziierten Cardio-Risikos ist angezeigt, wenn Risikofaktoren oder Vorstufen einer Arteriosklerose vorliegen. Dazu zählen Bluthochdruck, Hyperlipidämie, Hyperhomocysteinämie und eine erhöhte Intima-Media-Dicke in der Duplexsonografie.
Systemisches TMAO ist ein Schlüsselmolekül in der Pathogenese der Arteriosklerose: Es beeinflusst den Cholesterin- und Gallensäurestoffwechsel und treibt Entzündungen der Gefäßwand voran.
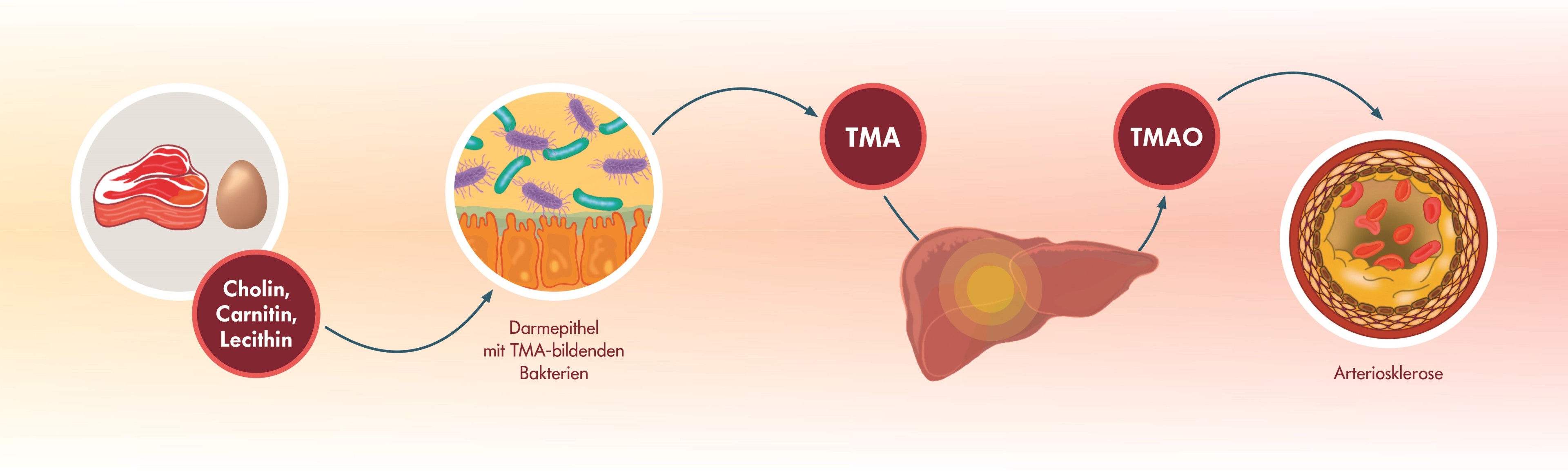
Einige Darmbakterien setzen Cholin, Carnitin und Lecithin zu Trimethylamin (TMA) um. Cholin, Carnitin und Lecithin sind zum Beispiel in Fleisch oder Eiern, aber auch in Nahrungsergänzungsmitteln für den Muskelaufbau enthalten.
Das gebildete TMA ist ein Gas, das gut resorbiert und von Leberenzymen rasch zu Trimethylamin-N-oxid (TMAO) oxidiert wird.
Erhöhte TMAO-Spiegel sind mit einem höheren Risiko für kardiovaskuläre Erkrankungen assoziiert – insbesondere Herzinfarkt und Schlaganfall. TMAO steigert die Konzentration des Makrophagen-spezifischen Cholesterins und die Bildung von Schaumzellen in der Gefäßwand. Außerdem treibt es Entzündungen der Gefäßwand voran und erhöht die Aktivität der Thrombozyten [15].
Der Nachweis der TMA-Bildner im Stuhl gibt Aufschluss über die Gefäßbelastung bei einer Fleisch- und Ei-reichen Ernährung. Auch Sportler sollten ihr Darm-assoziiertes Cardio-Risiko kennen und beachten, wenn sie Carnitin-haltige Nahrungsergänzungsmittel für den Muskelaufbau zu sich nehmen. Ist die Konzentration der TMA-Bildner erhöht, sollte der Patient oder die Patientin den Fleisch- und Ei-Konsum reduzieren. Zusätzlich lässt sich die bakterielle TMA-Produktion zum Beispiel über Phytotherapeutika wie Allicin aus Knoblauch senken [16].
Hepar-Risiko - spezifische Parameter

H2S-bildende Mikrobiota und Hepatotoxine aus dem Darm belasten die Leber
Bei einer unklaren Erhöhung der Leberwerte, aber auch bei chronischen Lebererkrankungen und einer manifesten NAFLD ist es deshalb zielführend, das Darm-assoziierte Hepar-Risiko zu ermitteln. Das ermöglicht ein gezieltes therapeutisches Eingreifen, um die Belastung der Leber aus dem Darm zu verringern.



Bilophila wadsworthia fördert Leberverfettung
Das Darmbakterium Bilophila wadsworthia kann Schwefelwasserstoff (H2S) produzieren, der in größeren Mengen Entzündungen der Darm-Schleimhaut befeuert. Außerdem erhöht Bilophila wadsworthia die Schleimhaut-Permeabilität und dysreguliert den Gallensäure-Stoffwechsel.
Das verschobene Gallensäure-Spektrum verändert die Blutzuckerregulation und fördert die Entstehung einer Fettleber.
Bilophila wadsworthia verstärkt die ungünstigen Auswirkungen einer Ernährung, die reich an gesättigten Fettsäuren ist. Auf eine entsprechende Überernährung reagiert das Darmbakterium mit vermehrtem Wachstum, wie eine aktuelle Studie mit übergewichtigen und adipösen Erwachsenen gezeigt hat [17].
Ungesättigte Fettsäuren erhöhten dagegen die Zellzahlen der Buttersäure-Produzenten. Hatte Bilophila wadsworthia im Darm erhöhte Zellzahlen erreicht, befeuerte es bei den Probanden noch einmal die Leberverfettung, wenn sie viele gesättigte Fettsäuren zu sich nahmen.
Gallensäuren werden zunehmend als wichtige Regulatoren des Stoffwechsels erkannt. Bilophila wadsworthia verändert den Gallensäure-Stoffwechsel. Dadurch werden die Blutzuckerregulation gestört und die Entstehung einer Fettleber gefördert.
Zusätzlich produziert Bilophila wadsworthia das Gas Schwefelwasserstoff, das chronisch-entzündliche Erkrankungen und Krebs fördert, wenn es in größeren Mengen gebildet wird. In niedriger Konzentration wirkt es dagegen entzündungshemmend auf die Darmschleimhaut, die das Gas auch selbst bildet [18].

Iso-Fettsäuren als Marker für die Hepatotoxin-Bildung
Die Konzentration der iso-Fettsäuren zeigt an, wie stark die Darmbakterien Proteine abbauen und dabei Hepatotoxine wie
Ammoniak, Indol, Skatol und Phenol bilden.
Ursache eines gesteigerten bakteriellen Proteinabbaus können hohe Zellzahlen proteolytischer Bakterien im Darm sein und eine Ernährung,
die reich an tierischem Protein ist.
Aus dem Hepar-Risiko des CHM lässt sich ableiten, ob eine endogene Leberbelastung vorliegt und ob die Zusammensetzung der Darm-Mikrobiota eine Verfettung der Leber begünstigt. Ist das der Fall, können Hepatotoxine gebunden und ausgeleitet werden, bevor es zu Gewebeschädigungen kommt. Eine Ernährungsumstellung und Präparate mit Milchsäure-bildenden Bakterien können das Wachstum von proteolytischen Bakterien und Bilophila wadsworthia [14] begrenzen und damit dem Fettleber-Risiko entgegenwirken.

Metabolic-Risiko – Spezifische Parameter
Kurzkettige Fettsäuren und verzweigtkettige Aminosäuren als Signalgeber
Die kurzkettigen Fettsäuren Essigsäure und Propionsäure und die von Prevotella copri gebildeten verzweigtkettigen Aminosäuren (branched chain amino acids = BCAA) spielen bei der Pathogenese der Adipositas und des Diabetes Typ 2 eine wichtige Rolle.
Die Messung der Parameter ist deshalb bei Übergewicht, Pre-Diabetes und Metabolischem Syndrom sinnvoll. Eine anschließende, auf die Mikrobiota und ihre Stoffwechselprodukte ausgerichtete Therapie ermöglicht es, einer metabolischen Entgleisung entgegenzusteuern.
BCAA gelangen über tierische Lebensmittel und den Stoffwechsel der Darmbakterien in den Blutkreislauf. Der menschliche Stoffwechsel kann die BCAA nicht bilden.
Prevotella copri ist das Darmbakterium, das bei der Produktion der BCAA die größte Rolle spielt – und damit auch insgesamt bei der Entstehung der Insulinresistenz, wie eine dänische Kohorte mit nicht-diabetischen Männern aufdeckte [20].
In einer weiteren Untersuchung waren bei Patienten mit Typ-2-Diabetes die Zellzahlen von Prevotella copri und die LPS-Konzentrationen erhöht [12].
BCAA sind unter den Aminosäuren einzigartig, da sie weder im Darm noch in der Leber verstoffwechselt werden können. Ihre zirkulierenden Konzentrationen dienen deshalb vielen Zielgeweben als Signal für die Nährstoffversorgung [12]. Besonders Leucin liefert dem körpereigenen Sensorsystem – dem mTOR-Komplex – Informationen über die Verfügbarkeit von Aminosäuren. Bei guter Versorgungslage stimuliert der mTOR-Komplex die Herstellung neuer Proteine, aber auch die Einlagerung von Fett in metabolisch aktiven Geweben. Bleibt die Nährstoff-Zufuhr dagegen aus, schaltet mTOR vom anabolen in den katabolen Stoffwechsel um. Dadurch werden Reinigungsprozesse in Gang gesetzt und defekte Proteine entsorgt, die für die Zelle oder das Organ schädlich werden können.
Ist der mTOR-Komplex über Leucin aktiviert, senken nachgeschaltete Mechanismen die insulinabhängige Glukoseaufnahme in die Zellen [12]. Die Folge ist eine Hyperglycämie. Aktiviert Prevotella copri ständig über die Leucin-Produktion den mTOR-Komplex, kann das in eine Insulinresistenz [21] und in der Folge in einen Typ-2-Diabetes münden.
BCAA mästen zusätzlich die ausdifferenzierten Adipozyten: Leucin und Isoleucin tragen zu etwa einem Drittel zur Lipogenese in den Adipozyten bei [24]. Prä-Adipozyten verwenden dagegen Glukose und Glutamin für die Fettsäuresynthese.
Durch ihre Signalfunktion eignen sich die BCAA hervorragend als Biomarker. Ein Anstieg ist mit einem fünffach erhöhten Risiko für Typ-2-Diabetes verbunden [13] und prognostiziert Diabetes bis zu zwölf Jahre vor seiner Manifestation [25].
Die von der Darm-Mikrobiota gebildete Essigsäure fördert Fetteinlagerung bei einer fettreichen Ernährung. Gleichzeitig verstärkt sie das Hungergefühl und regt die Gluconeogese an. Das stellt dem Organismus zusätzliche Kalorien zur Verfügung.
Auch eine zuckerreiche Ernährung kann die Essigsäure-Konzentration im Darm erhöhen, da einige Darmbakterien einfache Zucker zu Essigsäure umsetzen.
Erhöhte Propionsäurespiegel im Kolon können dagegen eine Gewichtszunahme verhindern – vor allem bei übergewichtigen Erwachsenen. Studien haben gezeigt: Propionsäure verstärkt das Sättigungsgefühl. Dadurch können die Kalorienaufnahme reduziert, der Cholesterinspiegel gesenkt und die Insulinsensitivität verbessert werden.
Eine gezielte Ernährungsumstellung auf Basis des CHM-Befundes und die Gabe von Phytotherapeutika können die
Konzentration der BCAA senken [12] und das Mengenverhältnis von Propionsäure zu Essigsäure beeinflussen. Das verändert
die Signale, die die Darm-Mikrobiota an den menschlichen Stoffwechsel sendet, und verstärkt damit das Sättigungsgefühl,
verbessert die Insulinsensitivität und verringert die kalorische Ausbeute aus der Nahrung.
Die CHM-Basis-Parameter

Ein erhöhter LPS-Eintrag aus der Darm-Mikrobiota bei einer hyperpermeablen Darm-Schleimhaut ist eng mit der Entstehung von Adipositas und Insulinresistenz verzahnt. Beides gehört zu den Hauptursachen von kardiovaskulären Erkrankungen, NAFLD und Diabetes Typ 2. (3)
Bestimmte Darmbakterien bilden bei ausreichender Ballaststoff-Zufuhr Buttersäure, die viele positive Funktionen hat. Buttersäure ernährt das Darmepithel, wirkt antidiabetogen und mindert Hungergefühle. Verringerte Buttersäuremengen tragen über den Weg der Silent Inflammation zu einem erhöhten Risiko für kardiovaskulären Erkrankungen, NAFLD und Diabetes Typ 2 bei.3
Ist die Ernährung regelmäßig arm an Ballaststoffen und reich an gesättigten Fettsäuren („Western Diet“), verändert sich die Zusammensetzung der Darm-Mikrobiota. Die Bakterien produzieren weniger Buttersäure und den Darm-Epithelzellen fehlt damit der Nährstoff. Die Folgen: Es fehlt die antidiabetogene und appetithemmende Wirkung der Buttersäure. Parallel steigt das Risiko für Leaky Gut an.
Ist die Darm-Schleimhaut hyperpermeabel, gelangen Bakterien (16) und übermäßig viel bakterielles LPS sowie Hepatotoxine in den Blutkreislauf.1 Eine metabolische Endotoxinämie entsteht, die zur fortlaufenden Freisetzung pro-inflammatorischer Zytokine und damit einer Silent Inflammation führt. Diese kann eine Insulinresistenz vorantreiben und zur Entstehung von Arteriosklerose und Bluthochdruck beitragen (17,3). Zudem kann die Silent Inflammation die Leberfunktion beeinträchtigen und eine Fettleber begünstigen. Zusätzlich steigert bakterielles LPS die Herzfrequenz und aktiviert den Sympathikus, was als frühe Ursache der Hypertonie gilt (17).
Wissenschaftler sehen die Senkung der LPS-Konzentration im Plasma als wirkungsvolle Strategie an, um Stoffwechselerkrankungen zu kontrollieren (18).
Die Ernährung beeinflusst die Zusammensetzung der Darm-Mikrobiota stark und damit auch den LPS-Eintrag und die Buttersäure-Produktion. Problematisch ist vor allem eine Ernährung, die reich an einfachen Kohlenhydraten, Proteinen oder gesättigten Fettsäuren ist. Ein reiches Proteinangebot fördert das Wachstum der LPStragenden Mikrobiota. Die Lipopolysaccharide (LPS) in der äußeren Zellmembran Gram-negativer Bakterien wirken als Endotoxine. Unter bestimmten Bedingungen können sie die Darmbarriere passieren und ihre toxische Wirkung entfalten.




Bandbreite natürlicher Therapie-Optionen
Der CHM-Befund ermöglicht es Ihnen, Mikrobiota-bedingte Belastungen der Leber und der Blutgefäße gezielt zu minimieren. Sie können darüber hinaus den Mechanismen der Darm-Mikrobiota entgegensteuern, die für ein gesteigertes Hungergefühl und die Entstehung einer Insulinresistenz verantwortlich sind.
Haben sich bereits eine Arteriosklerose, eine NAFLD oder ein Diabetes Typ 2 manifestiert, kann eine gezielte Modulation der mikrobiellen Stoffwechselprodukte die Therapie wirkungsvoll unterstützen und den Behandlungserfolg verbessern.[1]
Dafür steht Ihnen eine Bandbreite natürlicher Therapieformen zur Verfügung:
- Probiotische Therapie
- Ernährungsumstellung
- Phytotherapie
- Orthomolekulare Therapie
- Adsorbenzien (Heilerden)
- Komplexhomöopathie
Zum CHM-Befund können Sie individuelle Ernährungs- und Therapieempfehlungen für Ihre Patienten anfordern.
Bei Fragen steht Ihnen unsere medizinische Hotline aus erfahrenen Ärztinnen, Ärzten und Heilpraktikerinnen zur Seite.
Diagnostische Parameter
- kurzkettige Fettsäuren
- BCAA-Bildner
- LPS-tragende Mikrobiota
- H2S-Bildner
- TMA-Bildner
Was kreuze ich an?
Sie finden die CardioHeparMetabolic-Diagnostik auf unseren Auftragsformularen für privatversicherte Patienten und selbstzahlende, gesetzlich versicherte Patienten auf der Seite 1, rechte Spalte, sowie auf den Auftragsformularen für Gynäkologen auf Seite 2, rechte Spalte unter der Ziffer:
- a43 KyberBiom-CardioHeparMetabolic
Haben Sie noch Fragen? Unter unseren Hotline-Nummern beantworten wir sie gerne.
Das könnte Sie auch interessieren
Literatur
- Tomasova, L. et al.: The impact of gut microbiota metabolites on cellular bioenergetics and cardiometabolic health. 2021, Nutr Metab (Lond) 18(1): 72. doi: 10.1186/s12986-021-00598-5.
- Gojda, J. and Cahova, M.: Gut Microbiota as the Link between Elevated BCAA Serum Levels and Insulin Resistance. 2021, Biomolecules 11(10): 1414. doi: 10.3390/biom11101414.
- Saad, M.J. et al.: Linking Gut Microbiota and Inflammation to Obesity and Insulin Resistance. 2016, Physiology (Bethesda) 31(4): 283-293. doi: 10.1152/physiol.00041.2015.
- Natividad, J.M. et al.: Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice. 2018, Nat Commun. 9(1): 2802. doi: 10.1038/s41467-018-05249-7.
- Zhu, W. et al.: Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. 2016, Cell 165(1): 111-124. doi: 10.1016/j.cell.2016.02.011.
- Li, X.S. et al.: Gut microbiota-dependent trimethylamine N-oxide in acute coronary syndromes: a prognostic marker for incident cardiovascular events beyond traditional risk factors. 2017, Eur Heart J. 38(11): 814-824. doi: 10.1093/eurheartj/ehw582.
- Tang, W.H. et al.: Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk. 2013, N Engl J Med. 368(17): 1575-1584. doi: 10.1056/NEJMoa1109400.
- Tang, W.H. et al.: Prognostic value of elevated levels of intestinal microbe-generated metabolite trimethylamine-N-oxide in patients with heart failure: refining the gut hypothesis. 2014, J Am Coll Cardiol. 64(18): 1908-1914. doi: 10.1016/j.jacc.2014.02.617.
- Wu, W.-K. et al.: Dietary allicin reduces transformation of L-carnitine to TMAO through impact on gut microbiota. 2015, Journal of Functional Foods, 15: 408-417. doi.org/10.1016/j.jff.2015.04.001
- Jian, C. et al.: Impact of short-term overfeeding of saturated or unsaturated fat or sugars on the gut microbiota in relation to liver fat in obese and overweight adults. 2021, Clin Nutr 40(1): 207-216. doi: 10.1016/j.clnu.2020.05.008.
- https://www.uni-konstanz.de/universitaet/aktuelles-und-medien/aktuelle-meldungen/presseinformationen/presseinformationen/neue-funktionen-im-darm-mikrobiom-entdeckt/
- Agus, A. et al.: Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. 2018, Cell Host Microbe 23(6): 716-724. doi: 10.1016/j.chom.2018.05.003.
- Perry, R.J. et al.: Acetate mediates a microbiome-brain-β-cell axis to promote metabolic syndrome. 2016, Nature 534(7606): 213-217. doi: 10.1038/nature18309.
- Weschenfelder, C. et al.: Adipokines and Adipose Tissue-Related Metabolites, Nuts and Cardiovascular Disease. 2020, Metabolites 10(1): 32. doi: 10.3390/metabo10010032.
- Pedersen, H.K. et al.: Human gut microbes impact host serum metabolome and insulin sensitivity. 2016, Nature 535(7612): 376-381. doi: 10.1038/nature18646.
- Lynch, C.J. and Adams, S.H.: Branched-chain amino acids in metabolic signalling and insulin resistance. 2014, Nat Rev Endocrinol. 10(12): 723-736. doi: 10.1038/nrendo.2014.171.
- Kaneto, H. et al.: Multifaceted Mechanisms of Action of Metformin Which Have Been Unraveled One after Another in the Long History. 2021, Int J Mol Sci. 22(5): 2596. doi: 10.3390/ijms22052596.
- Wilhelmi de Toledo, F. et al. Unravelling the health effects of fasting: a long road from obesity treatment to healthy life span increase and improved cognition. 2020, Ann Med. 52(5): 147-161. doi: 10.1080/07853890.2020.1770849.
- Green, C.R. et al.: Branched-chain amino acid catabolism fuels adipocyte differentiation and lipogenesis. 2016, Nat Chem Biol. 12(1): 15-21. doi: 10.1038/nchembio.1961.
- Wang, T.J. et al.: Metabolite profiles and the risk of developing diabetes. 2011, Nat Med. 17(4): 448-453. doi: 10.1038/nm.2307.
- Hamaya, R. et al.: Association of Plasma Branched-Chain Amino Acid With Biomarkers of Inflammation and Lipid Metabolism in Women. 2021, Circ Genom Precis Med 14: e003330. doi:10.1161/CIRCGEN.121.003330.
- Cândido, T.L.N. et al.: Effects of dietary fat quality on metabolic endotoxaemia: a systematic review. 2020, Br J Nutr. 124(7): 654-667. doi: 10.1017/S0007114520001658.
- Massier, L. et al.: Adipose tissue derived bacteria are associated with inflammation in obesity and type 2 diabetes. 2020, Gut 69(10): 1796-1806. doi: 10.1136/gutjnl-2019-320118.
- Verhaar, B.J.H. et al.: Gut Microbiota in Hypertension and Atherosclerosis: A Review. 2020, Nutrients. 12(10): 2982. doi: 10.3390/nu12102982.
- Cani, P.D. et al. Metabolic endotoxemia initiates obesity and insulin resistance. 2007, Diabetes 56(7): 1761-1772. doi: 10.2337/db06-1491.
- Dhamija, E. et al.: Non-alcoholic fatty liver disease associated with hepatocellular carcinoma: An increasing concern. 2019, Indian J Med Res. 149(1):9-17. doi: 10.4103/ijmr.IJMR_1456_17.


