Für Ärzte und Therapeuten
Darm Hirn Achse & Reizdarmsyndrom
Reizdarmsyndrom und Darm Hirn Achse
Darm und Gehirn sind miteinander verbunden. Sie kommunizieren bidirektional über die sogenannte Darm Hirn Achse (Gut Brain Axis). Daher wird das Reizdarmsyndrom, fachlich, nicht mehr nur als eine gastrointestinale Störung betrachtet. Vielmehr wird es inzwischen als medizinisch unerklärbare Störung der bidirektionalen Kommunikation zwischen Darm und Gehirn anerkannt¹.
In Deutschland leiden geschätzte 13 Prozent der Bevölkerung unter dem Reizdarmsyndrom (RDS), Frauen sind deutlich häufiger betroffen als Männer.
In der S3 Leitlinie2 ist das Reizdarmsyndrom definiert: Die Patientin oder der Patient leidet unter chronischen, länger als drei Monate anhaltenden oder rezidivierenden Beschwerden. Diese werden von der Patientin oder dem Patienten und der Ärztin oder dem Arzt auf den Darm bezogen. Die Beschwerden wie Bauschmerzen und Blähungen gehen in der Regel mit Stuhlgangveränderungen einher und begründen, dass der Patient oder die Patientin deswegen Hilfe sucht. Voraussetzung für die Diagnose Reizdarm ist, dass Erkrankungen ausgeschlossen werden, welche die Symptome auslösen können. Dazu gehören zum Beispiel akute Magen-Darm-Erkrankungen, chronisch-entzündliche Darmerkrankungen aber auch Krebserkrankungen.
In der ICD10 wird der Diagnose Reizdarmsyndrom der Diagnoseschlüssel K58 zugeordnet.
Das Reizdarmsyndrom lässt sich in Untergruppen einteilen:
- Diarrhö-prädominantes Reizdarmsyndrom (RDS-D/IBS-D)
- Obstipation-prädominantes Reizdarmsyndrom (RDS-O/IBS-O)
- Reizdarmsyndrom mit wechselnden Stuhlgewohnheiten (RDS-M/IBS-M), auch gemischt/alternierend bezeichnet
Dysbiose - Verändertes Mikromilieu
Das Mikromilieu des Darms von Reizdarmsyndrom-Patientinnen und -Patienten ist oft verändert. Auffällig sind eine Dysbiose der Darm-Mikrobiota und eine erhöhte Permeabilität der Darmschleimhaut.
Das Wechselspiel von Darm-Mikrobiota, Schleimhaut und mukosalem Immunsystem bestimmt das Mikromilieu im Darm und damit auch die Verdauung. Faktoren wie die Ernährung, die psychische Gesundheit, Infektionen oder die Einnahme von Medikamenten können auf die drei Ebenen einwirken und das Mikromilieu nachhaltig verändern. Etwa jedes vierte Reizdarmsyndrom entsteht zum Beispiel nach einer Gastroenteritis, oft ist es auch Folge einer oder mehrerer Antibiosen.
Im Rahmen unserer Gut-Brain-Axis Reizdarm-Diagnostik bestimmen wir Histamin, GABA, Tryptophan und Serotonin im Stuhl. Diese bilden eine wichtige Grundlage, um das komplexe Krankheitsbild des Reizdarmsyndroms zielgerichtet zu behandeln.

Darm Hirn Achse und Reizdarmsyndrom assoziierte Symptome
Die mit dem Reizdarmsyndrom assoziierten Störungen der Darm-Hirn-Interaktion äußern sich in vielfältiger Weise. So leiden Reizdarmpatientinnen und -patienten unter anderem an:
- viszeraler Hypersensitivität
- Schmerzen
- Schlafstörungen
- Motilitätsstörungen (Diarrhö und/oder Obstipation)
- Übelkeit und Erbrechen
- Entzündungen
In der Darmschleimhaut von Betroffenen mit Reizdarmsyndrom finden sich zudem häufig pathophysiologische Veränderungen wie ein übermäßig durchlässiges Darmepithel (Leaky-Gut-Syndrom)².

Diagnostische Parameter
Was kreuze ich an?
Sie finden die Gut-Brain-Axis Reizdarm-Diagnostik auf den Untersuchungsaufträgen für privatversicherte Patienten und selbstzahlende, gesetzlich versicherte Patienten auf den Seiten 1 und 2 unter den Ziffern:
- n40 Diagnostik Reizdarm-assoziierter Symptome - Beinhaltet KyberBiom, Gut-Brain-Axis Reizdarm, Zonulin, a1-Antitrypsin
- m10 Gut-Brain-Axis Reizdarm - Spezifische Diagnostik der Darm-Hirn-Kommunikation zur erweiterten Abklärung Reizdarm-assoziierter Beschwerden


KyberBiom® und Permeabilitätsmarker
Eine Dysbiose der Darm-Mikrobiota und das Leaky-Gut-Syndrom sind typisch für viele Reizdarmsyndrom-Patientinnen und -Patienten. Deshalb empfehlen wir die Kombination der Gut-Brain-Axis Reizdarm-Diagnostik mit der KyberBiom®-Diagnostik inklusive Bestimmung der Permeabilitätsmarker Zonulin und α1-Antitrypsin, um eine ganzheitliche Therapie Reizdarm-assoziierter Symptome zu ermöglichen.
Unsere KyberBiom®-Diagnostik erfasst Schlüsselorganismen aus sieben funktionellen Gruppen der Mikrobiota. Dadurch lassen sich relevante Störungen des mikrobiellen Gleichgewichts erkennen und mit Hilfe von individuellen Therapie- und Ernährungsmaßnahmen die Mikrobiota wieder ins Gleichgewicht gebracht werden.
Zusätzlich erfassen wir mit der KyberBiom®-Diagnostik den FODMAP-Typ. Bei den FODMAPs handelt es sich um Zuckerarten, für die es im Darm keine geeigneten Verdauungsenzyme oder Transportsysteme gibt. Da die Zucker nicht verdaut werden, gelangen sie unverändert in den Dickdarm. Dort wirken die Zucker osmotisch: Das ins Darmlumen einströmende Wasser verdünnt den Stuhl und beschleunigt die Darmpassage. Gleichzeitig erzeugen die Bakterien Gase, wenn sie die Zucker fermentieren. Das erhöht den Druck auf die Darmwand und löst Reizdarm-Schmerzen aus. Es hängt von der Zusammensetzung der Mikrobiota ab, ob Reizdarm-Patientinnen und -Patienten von der Diät profitieren6. Nur bei einem FODMAP-Typ 3 und teilweise bei einem FODMAP-Typ 2 kann eine FODMAP-arme Ernährung Reizdarm-Beschwerden oft lindern. Es entstehen weniger Gase und damit weniger schmerzhafte Dehnungsreize.
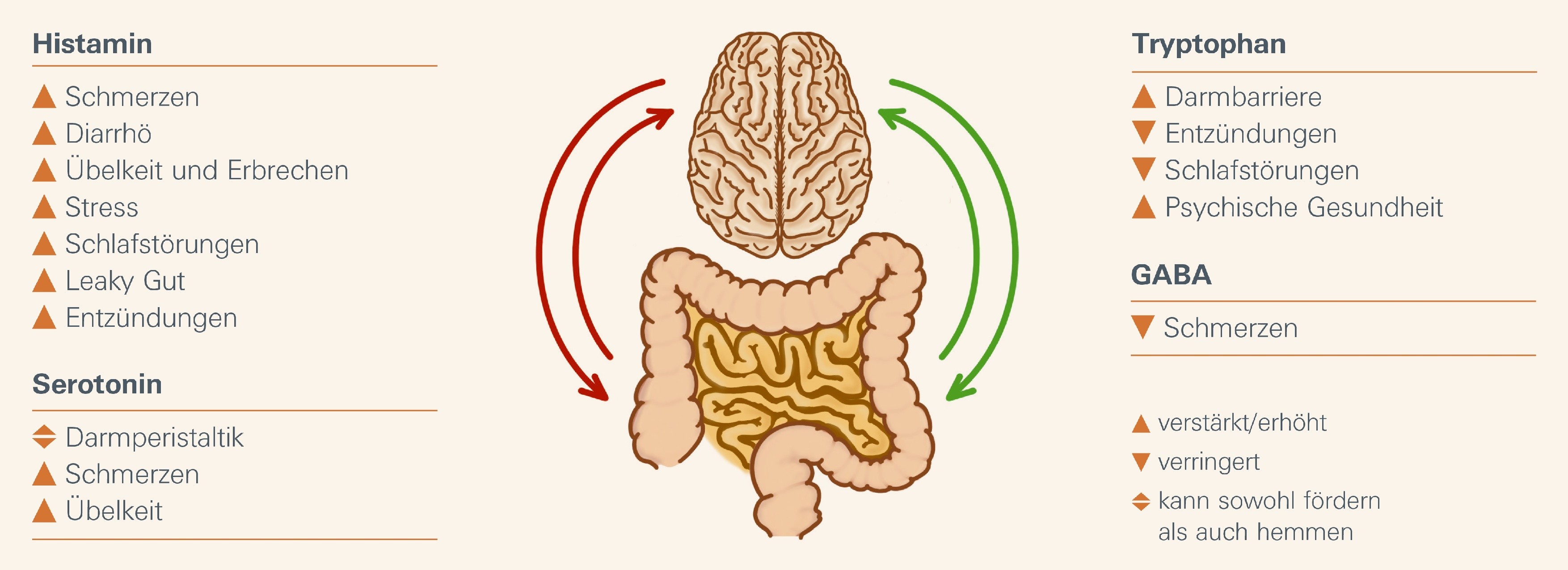
Darm Hirn Achse & Reizdarmsyndrom: Parameter
Die Darm-Mikrobiota beeinflusst eine Reihe von enteralen Substanzen wie Hormone und Neurotransmitter. Diese modulieren die Darm-Hirn-Interaktion und die Darmschleimhaut und tragen somit zum Reizdarm-Geschehen bei.
Zu diesen Substanzen gehören:

Youtube inaktiv
Aufgrund Ihrer Cookie-Einstellungen kann dieses Modul nicht geladen werden.
Wenn Sie dieses Modul sehen möchten, passen Sie bitte Ihre Cookie-Einstellungen entsprechend an.

Enterales Histamin verstärkt das Reizdarmsyndrom mehrfach
Histamin fördert Schmerzen, Diarrhö, Übelkeit und Erbrechen über enterale Nerven. Es verstärkt zudem Stress sowie Ein- und Durchschlafstörungen. Histamin führt außerdem zu einer erhöhten Permeabilität der Darmmukosa und trägt somit zum Leaky-Gut-Syndrom bei. Histamin wirkt zudem entzündungsfördernd.
Histamin im Darm wirkt als Gewebshormon und Neurotransmitter vielfach auf die Reizdarm-Symptomatik. Im Darm bindet Histamin an H1-Rezeptoren enteraler Nerven der Submukosa und triggert so Schmerzen, Diarrhö sowie Übelkeit und Erbrechen³ ⁴. In den Nebennieren bewirkt Histamin über Bindung an H1-Rezeptoren die Ausschüttung von Adrenalin. Damit kann Histamin den Stresszustand des Reizdarm-Betroffenen erhöhen⁵. Permanenter Lebensstress gilt sowohl als Auslöser als auch als prognoserelevant für die Heilung eines Reizdarmsyndroms² ⁶. Über H1-Rezeptoren von Gehirn-Neuronen wirkt Histamin ähnlich stimulierend wie Koffein. So kann ein Übermaß an Histamin Ein- und Durchschlafstörungen begünstigen⁵.
Viele Reizdarm-Patientinnen und -Patienten leiden unter pathophysiologischen Veränderungen der Darmmukosa wie dem Leaky-Gut-Syndrom² und niedriggradigen Entzündungen (Silent Inflammation)⁷. Histamin erhöht die Permeabilität der Darmmukosa und trägt so zum Leaky-Gut-Syndrom bei³. Zudem moduliert Histamin über neutrophile Granulozyten und regulatorische T-Zellen das angeborene und erworbene Immunsystem und wirkt so auf mehreren Wegen entzündungsfördernd⁸.
Es gibt vier Quellen, die den Histamingehalt im Darm erhöhen können. Dies sind zum einen bestimmte Nahrungsmittel, aber auch Medikamente (eine Übersicht finden Sie hier). Außerdem produzieren bestimmte Darmbakterien größere Mengen an Histamin⁹. Darüber hinaus synthetisieren auch menschliche Zellen Histamin, z. B. enterochromaffine Zellen der Darmschleimhaut⁹. Hinzu kommen die enteralen Mastzellen, die als Schlüsselfaktoren für das Reizdarmsyndrom gelten¹⁰. Sie können große Mengen an Histamin freisetzen.
Histamin ist die häufigste von mehreren hundert Substanzen, die von Mastzellen gespeichert werden⁵ ⁹. Werden Mastzellen aktiviert, kommt es zur Degranulation und Freisetzung von Histamin und anderen Substanzen wie Proteasen. Diese begünstigen wie Histamin Schmerzen11 und ein Leaky Gut bei Reizdarmbetroffenen¹² ¹³.
Mastzellen kommen natürlicherweise im Verdauungstrakt vor. Dort umgeben sie Blutgefäße, Neuronen und Nervenfasern und unterstützen den Schutz der einzelligen Darmbarriere⁵. Im Darm von Reizdarmpatientinnen und -patienten finden sich jedoch erhöhte Zahlen an Mastzellen und pathologische Mastzellstrukturen. Das Reizdarmsyndrom führt zu einer leichteren Degranulation der Mastzellen im Vergleich zu Gesunden¹² ¹³. Reizdarmpatientinnen und -patienten haben also grundsätzlich ein hohes Histaminpotential im Darm. Auch mechanische Reize führen zur Degranulation von Mastzellen, z. B. wenn Meteorismen die Darmwand dehnen.
Eine FODMAP-arme Ernährung lindert oft Reizdarm-Symptome. Es entstehen weniger Gase und damit weniger schmerzhafte Dehnungsreize, welche die Histaminfreisetzung aus den Mastzellen triggern. Infolgedessen sinkt der Histaminspiegel unter einer FODMAP-armen Diät bis um das Achtfache¹⁴. Unsere KyberBiom®-Diagnostik kann den Erfolg einer FODMAP-armen Ernährung für Ihre Reizdarm-Patientinnen und -Patienten prognostizieren.
Histaminintoleranz
Bei hohen Histamin-Werten empfehlen wir die differentialdiagnostische Abklärung einer Histaminintoleranz. Bei Vorliegen einer Histaminintoleranz kann eine Histamin-arme Ernährung Reizdarm-assoziierte Beschwerden lindern.

GABA lindert Schmerzen des Reizdarmsyndrom
GABA ist der wichtigste inhibitorische Neurotransmitter im zentralen und peripheren Nervensystem. Der Neurotransmitter hemmt das intestinale Schmerzempfinden über die Darm Hirn Achse.
Der Neurotransmitter γ-Aminobuttersäure, kurz GABA, ist der wichtigste inhibitorische Neurotransmitter im zentralen und peripheren Nervensystem¹⁵. GABA hat eine Vielzahl von Funktionen. Dazu gehört die Regulation von Angst, Stress, des zirkadianen Rhythmus und des Schlafes. Zusätzlich trägt GABA zur Verbesserung des Gedächtnisses und der Stimmung bei und beeinflusst unser Schmerzempfinden¹⁶. GABA wird unter anderem von Darmbakterien, wie bestimmten Bifidobakterien und Laktobazillen, gebildet. Sie blockiert die neuronale Weiterleitung von Schmerzreizen aus dem Darm zum Gehirn. Enterale GABA hemmt also über die Darm-Hirn-Achse das intestinale Schmerzempfinden¹⁶. Wie aktuelle Studien zeigen, hemmt GABA auch die Aktivierung von Nozizeptoren im enteralen Nervensystems des Darms.
Die Neurone des enterischen Nervensystems haben keinen direkten Kontakt zum Darmlumen¹⁷. GABA wirkt daher erst nach Aufnahme über GABA-Transporter der Darmepithelzellen schmerzlindernd¹⁸.
Wichtig zu wissen: Die GABA-Transporter sind pH-abhängig. Wie Untersuchungen an Zellkulturen zeigen, ist ein pH-Wert zwischen 5,3 und 6,2 optimal. Bereits ab einem pH-Wert von 6,5 nimmt die Aufnahmefähigkeit der Darmepithelzellen für GABA stark ab. Bei pH-Werten von 7,7 bis 8 passiert kaum noch GABA die Epithelbarriere¹⁸. Ein physiologischer, saurer pH-Wert im Darm ist Voraussetzung für die Wirkung von GABA: Reizdarmschmerzen effektiv zu lindern.
Tryptophan unterstützt vielseitig bei Reizdarmbeschwerden
Tryptophan unterstützt eine intakte Darmbarriere. Ein physiologischer Tryptophan-Stoffwechsel wirkt entzündungshemmend, fördert die psychische Gesundheit und verbessert die Schlafqualität.
Tryptophan ist eine Schlüsselsubstanz für viele physiologische Abläufe im menschlichen Körper. Der größte Teil des Tryptophans aus Nahrungsprotein wird im Dünndarm absorbiert¹⁹. Einen kleinen Teil des aufgenommenen Tryptophans nutzt der Körper für die Herstellung von Proteinen²⁰. Wie tierexperimentelle Studien zeigen, steigt unter Gabe von Tryptophan die Menge verschiedener Proteine im Darm an, die eine intakte Darmbarriere unterstützen. Dazu gehören verschiedene Tight-Junction-Proteine, der Schleimhautschutz-Antikörper sIgA und die sogenannten β-Defensine²¹. β-Defensine sind antimikrobielle Peptide, die als Teil der angeborenen Immunabwehr die Darmbarriere schützen. Zudem kann Tryptophan das sogenannte mTOR-Signalsystem aktivieren²¹. Es initiiert die Neubildung und Teilung von Enterozyten und damit die Neubildung und Reparatur des Darmepithels²². Tryptophan trägt so zu Reparaturprozessen des Darmepithels bei.
Der größte Teil des Nahrungs-Tryptophans wird im Dünndarm absorbiert. Eine gewisse Tryptophan-Menge gelangt jedoch auch in den Dickdarm, wo es von physiologischen Bakterien zu entzündungshemmenden und antioxidativ wirkenden Indol-Verbindungen abgebaut werden kann¹⁹. Zusätzlich entsteht aus Tryptophan Kynureninsäure, die antioxidativ, neuroprotektiv und entzündungshemmend wirkt²³.
Etwa 3-4 % des aufgenommenen Tryptophans verbraucht der Körper für die Serotoninsynthese in Gehirn und Darm. Im Darm entstehen 95 % des Serotonins im menschlichen Körper²³ ²⁴ ²⁵, auch über bestimmte Darmbakterien²⁶. Serotonin passiert nicht die Blut-Hirn-Schranke²³. Tryptophan hingegen kann mit Hilfe von Transportsystemen ins Gehirn gelangen²⁴. Eine ausreichende Aufnahme von Tryptophan über die Nahrung ist essentiell, damit der Körper ausreichende Serotoninmengen bilden und so Stimmungsschwankungen entgegenwirken kann. Viele Reizdarm-Patientinnen und -Patienten leiden zudem unter schlechter Schlafqualität²⁷. Tryptophan ist Ausgangssubstanz für die Melatoninsynthese und unterstützt so die Schlafqualität.
Tryptophan ist eine sogenannte essentielle Aminosäure. Der menschliche Körper kann Tryptophan also nicht selbst bilden. Unsere Nahrung ist die Hauptquelle für Tryptophan²³ ²⁸. Einige Darmbakterien, darunter E. coli, sind jedoch in der Lage, Tryptophan zu produzieren. Allerdings trägt die Darmmikrobiota nur geringfügig zur Tryptophanversorgung des Körpers bei. Wie Tierversuche gezeigt haben, kann die Gabe von probiotischen Bakterien zur Tryptophanversorgung beitragen. Dabei erhöhte die Gabe von Bifidobacterium infantis den Tryptophanspiegel im Plasma und verminderte die Bildung der proinflammatorischen Zytokine TNF-α, IL-6 und INF-γ²⁹.
Die Fruktose-Malabsorption, auch als intestinale Fruktoseintoleranz bezeichnet, tritt häufig bei Erwachsenen auf. Dabei führt eine verminderte Aktivität des Transportproteins GLUT-5 zur unvollständigen Fruktose-Aufnahme über die Dünndarm-Mukosa in das Blut. Damit bleiben unphysiologisch hohe Fruktose-Mengen im Darm zurück, die vermehrt Komplexe mit Tryptophan bilden. In Folge gelangt weniger Tryptophan aus dem Darm in das Blut und damit auch in das Gehirn. Die Abklärung einer Fruktoseintoleranz kann also einen physiologischen Tryptophan-Haushalt im Körper und damit die positiven Wirkungen von Tryptophan bei Reizdarm unterstützen.
Weitere Informationen zur Diagnostik einer Fruktoseintoleranz finden Sie hier.

Serotonin beeinflusst Darmperistaltik und Schmerzempfinden
Reizdarm Patientinnen und Patienten haben veränderte Serotoninspiegel im Darm². Serotonin (5-Hydroxytryptamin, 5-HT) ist ein Neurotransmitter, der hauptsächlich in enterochromaffinen Zellen des Dünndarms gebildet wird. Über verschiedene Rezeptoren beeinflusst Serotonin unter anderem die Darmperistaltik und das Schmerzempfinden³⁰. Im Darm sind hierbei vorrangig die Serotonin-Rezeptoren 5-HT1, 5-HT3 und 5-HT4 beteiligt.
Hohe Serotoninlevel begünstigen über den 5-HT3-Rezeptor viszerale Schmerzen² ³¹ ³² und Übelkeit³². Aktiviert Serotonin übermäßig die 5-HT3- und 5-HT4-Rezeptoren, führt dies zu vermehrten Kontraktionen im Darm, womit die Darmperistaltik gefördert wird. Das begünstigt die Entstehung von Diarrhö⁷ ³³ ³⁴ ³⁵. Bindet Serotonin jedoch an den 5-HT1-Rezeptor, so kann die Peristaltik auch gehemmt werden³¹. Somit kann eine Obstipation entstehen. Niedrige Serotoninlevel begünstigen allgemein eine Obstipation⁷ ³¹ ³².
Enterische Nerven von Reizdarm-Patientinnen und -Patienten können Phasen von Sensibilisierung und Desensibilisierung durchlaufen². Insbesondere beim gemischten Reizdarm-Typ spielt dies möglicherweise eine Rolle, da Durchfälle und Obstipation kurzfristig immer wieder abwechselnd auftreten.
Das könnte Sie auch interessieren
Literatur
1) Hillestad EMR et al. Gut bless you: The microbiota-gut-brain axis in irritable bowel syndrome. WJG 2022; 28: 412.
2) Layer P, Andresen V et al. Update S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie des Reizdarmsyndroms der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). Juni 2021 – AWMF-Registriernummer: 021/016.
3) Chen M et al. Neurotransmitter and IntestinalInteractions: Focus on the Microbiota-Gut-Brain Axis in Irritable Bowel Syndrome. Front. Endocrinol 2022;13:817100.
4) Zhong W et al. Mechanisms of Nausea and Vomiting: Current Knowledge and Recent Advances in Intracellular Emetic Signaling Systems. Int J Mol Sci 2021:22:5797.
5) Kaufmann K & Kaufmann S. Der Histamin Irrtum. VAK-Verlags GmbH, 5. Auflage 2022.
6) Löwe B. et al. The Development of Irritable Bowel Syndrome: A Prospective Community-Based Cohort Study. American Journal of Gastroenterology 2016;111:1320.
7) Chong PP et al. The Microbiome and Irritable Bowel Syndrome – A Review on the Pathophysiology, Current Research and Future Therapy. Front Microbiol 2019; 10: Artikel 1136.
8) Albert-Bayo M et al. Intestinal Mucosal Mast Cells: Key Modulators of Barrier Function and Homeostasis. Cell 2019;8:135.
9) Cryan J et al. The microbiota-gut-brain-axis. Physiol Rev 2019; 99: 1877.
10) Hasler WL et al. Mast cell mediation of visceral sensation and permeability in irritable bowel syndrome. Neurogastroenterology & Motility. 2022;34:e14339.
11) Cenac N et al. Protease-Activated Receptors as Therapeutic Targets in Visceral Pain. Current Neuropharmacology 2013;11:598.
12) Uranga JA et al. Mast Cell Regulation and Irritable Bowel Syndrome: Effects of Food Components with Potential Nutraceutical Use. Molecules. 2020; 25:4314.
13) Singh M et al. The relationship between mucosal inflammatory cells, specific symptoms, and psychological functioning in youth with irritable bowel syndrome. Nature Scientific Reports 2020; 10:11988.
14) McIntosh K et al. FODMAP alter symptoms and the metabolome of patients with IBS: a randomised controlled trail. Gut 2016; 0:1.
15) Hyland NP & JF Cryan. A gut feeling about GABA: focus on GABA-B receptors. Frontiers in Pharmacology 2010;1:Artikel 124.
16) Lagomarsino VN et al. Mechanisms of microbial–neuronal interactions in pain and nociception. Neurobiology of Pain 2021;9:1000562021.
17) Fung C & PV Berghe. Functional circuits and signal processing in the enteric nervous system. Cellular and Molecular Life Sciences (2020) 77:4505.
18) Thwaites DT et al. Gamma-aminobutyric acid (GABA) transport across human intestinal epithelial (Caco-2) cell monolayers. British Journal of Pharmacology 2000;129(3).
19) Gao K et al. Tryptophan Metabolism: A Link Between the Gut Microbiota and Brain. Adv Nutr 2020;11:709.
20) Wirthgen E & A Hoeflich. Endotoxin-Induced Tryptophan Degradation along the Kynurenine Pathway: The Role of Indolamine 2,3-Dioxygenase and Aryl Hydrocarbon Receptor-Mediated Immunosuppressive Effects in Endotoxin Tolerance and Cancer and Its Implications for Immunoparalysis. Journal of Amino Acids 2015; article ID 973548.
21) Liang H et al. Dietary L-Tryptophan Supplementation Enhances the Intestinal Mucosal Barrier Function in Weaned Piglets: Implication of Tryptophan-Metabolizing Microbiota. Int J Mol Sci 2019;20:20.
22) Kaur H & R Moreau. Role of mTORC1 in intestinal epithelial repair and tumorigenesis. Cell Mol Life Sci 2019;76:2525.
23) Bosi A et al. Tryptophan Metabolites Along the Microbiota-Gut-Brain Axis: An Interkingdom Communication System Influencing the Gut in Health and Disease. International Journal of Tryptophan Research 2020;13.
24) Richard DM et al. L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications. International Journal of Tryptophan Research 2009;2:45.
25) Badawy AA-B. Kynurenine Pathway of Tryptophan Metabolism: Regulatory and Functional Aspects. International Journal of Tryptophan Research 2017:10:1.
26) Roshchina, V. V. Evolutionary considerations of neurotransmitters in microbial, plant, and animal cells. in Microbial Endocrinology: Interkingdom Signaling in Infectious Disease and Health 17–52 (Springer New York, 2010).
27) Burr RL et al. Tryptophan Metabolites in Irritable Bowel Syndrome: An Overnight Time-course. J Neurogastroenterol Motil 2019;25:551.
28) Agus et al. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. Cell Host & Microbe 208;23:716.
29) Desbonnet L et al. The probiotic Bifidobacteria infantis: an assessment of potential antidepressant properties in the rat. J Psychiatr Res 2008;43:164-174.
30) Vahora IS et al. How Serotonin Level Fluctuation Affects the Effectiveness of Treatment in Irritable Bowel Syndrome. Cureus. 2020 Aug 19;12(8):e9871.
31) Gros M et al. Neurotransmitter Dysfunction in Irritable Bowel Syndrome: Emerging Approaches for Management. J Clin Med. 2021 Jul 31;10(15):3429.
32) Canadian Society of Intestinal Research. Irritable Bowel Syndrome (IBS) and Serotonin. Inside Tract® newsletter issue 144 – July/August 2004.
33) Houghton LA et al. Alosetron, a 5-HT3 receptor antagonist, delays colonic transit in patients with irritable bowel syndrome and healthy volunteers. Aliment Pharmacol Ther 2000;14:775-82.
34) Crowell MD. Role of serotonin in the pathophysiology of the irritable bowel syndrome. Br J Pharmacol. 2004 Apr;141(8):1285-93.
35) Camilleri M et al. Efficacy and safety of alosetron in women with irritable bowel syndrome: A randomised, placebo-controlled trial. Lancet 2000;355:1035-40.
